
eTMF-Systeme Markt
Marktforschungsbericht über elektronische Trial Master File (eTMF) Systeme Informationen nach Komponenten (Software und Dienstleistungen), nach Bereitstellungsmodus (Cloud/Web-basiert und Vor-Ort), nach Endbenutzer (Pharma- und Biotechnologieunternehmen, Auftragsforschungsorganisationen und andere) und nach Region (Nordamerika, Europa, Asien-Pazifik und Rest der Welt) – Marktprognose bis 2035
eTMF-Systeme Markt Trends
Steigende Akzeptanz elektronischer Aufzeichnungen zur Förderung des Marktwachstums
Die Pharma- und Biotech-Industrien sind stark reguliert, und eTMF-Systeme bieten Unternehmen eine Möglichkeit, ihre Dokumentation klinischer Studien in Übereinstimmung mit Vorschriften wie 21 CFR Part 11 zu verwalten. Dies war ein wesentlicher Wachstumsfaktor für eTMF-Systeme, da Unternehmen das Risiko von Strafen wegen Nichteinhaltung vermeiden und ihre regulatorischen Berichterstattungsprozesse optimieren möchten.
eTMF-Systeme ermöglichen eine bessere Zusammenarbeit und Zugänglichkeit der Dokumentation klinischer Studien, da Teammitglieder Dokumente in Echtzeit von überall mit einer Internetverbindung abrufen können. Dies ist mit dem Anstieg von Remote- und dezentralen klinischen Studien sowie dem Bedarf an Zusammenarbeit in multinationalen Studien zunehmend wichtig geworden. eTMF-Systeme können mit anderen Systemen für klinische Studien, wie z.B. elektronischer Datenerfassung (EDC) und Systemen zur Verwaltung klinischer Studien (CTMS), integriert werden, um eine umfassendere und optimierte Lösung für das Management klinischer Studien zu bieten.
Diese Integration ist ein Wachstumsfaktor für eTMF-Systeme geworden, da Unternehmen ihre Prozesse und Daten im Management klinischer Studien vereinheitlichen möchten.
Der allgemeine Trend zu elektronischen Aufzeichnungen in der Gesundheitsbranche war ebenfalls ein Wachstumsfaktor für eTMF-Systeme. Da immer mehr Unternehmen auf elektronische Aufzeichnungen für ihre Dokumentation klinischer Studien umsteigen, sind eTMF-Systeme zu einer natürlichen Wahl für die Verwaltung dieser Aufzeichnungen geworden.
eTMF-Systeme Markt Treiber
Globalisierung der klinischen Forschung
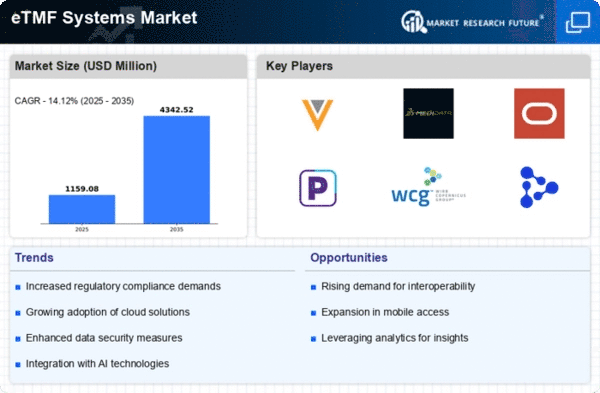
Die Globalisierung der klinischen Forschung hat einen erheblichen Einfluss auf den Markt für globale elektronische Trial Master File (eTMF) Systeme. Da Pharmaunternehmen ihre Aktivitäten über Grenzen hinweg ausweiten, wird die Notwendigkeit standardisierter Dokumentation und Datenverwaltung von größter Bedeutung. eTMF-Systeme bieten eine zentrale Plattform zur Verwaltung von Prüfungsdokumenten aus mehreren Regionen, um Konsistenz und Compliance mit unterschiedlichen regulatorischen Anforderungen sicherzustellen. Dieser Globalisierungstrend fördert nicht nur die Zusammenarbeit zwischen internationalen Forschungsteams, sondern beschleunigt auch den Arzneimittelentwicklungsprozess. Das erwartete Marktwachstum von 1,02 Milliarden USD im Jahr 2024 auf 4,35 Milliarden USD bis 2035 unterstreicht die entscheidende Rolle der eTMF-Systeme bei der Durchführung globaler klinischer Studien.
Steigende Nachfrage nach klinischen Studien
Der globale Markt für elektronische Trial Master File (eTMF) Systeme erlebt einen Anstieg der Nachfrage nach klinischen Studien, bedingt durch den Bedarf an effizientem Datenmanagement und regulatorischer Compliance. Da die Anzahl der klinischen Studien weiterhin steigt, übernehmen Organisationen zunehmend eTMF-Systeme, um Prozesse zu optimieren und die Zusammenarbeit zwischen den Beteiligten zu verbessern. Im Jahr 2024 wird der Markt mit 1,02 Milliarden USD bewertet, was die wachsende Anerkennung von eTMF-Systemen als wesentliche Werkzeuge für das Management von Studienunterlagen widerspiegelt. Dieser Trend wird voraussichtlich anhalten, wobei Prognosen auf ein Marktwachstum auf 4,35 Milliarden USD bis 2035 hinweisen, was die entscheidende Rolle von eTMF-Systemen im sich entwickelnden Umfeld der klinischen Forschung unterstreicht.
Regulatorische Compliance und Standardisierung
Die regulatorische Compliance bleibt ein entscheidender Treiber für den globalen Markt der elektronischen Trial Master File (eTMF) Systeme. Da die Regulierungsbehörden strenge Richtlinien für die Dokumentation klinischer Studien auferlegen, sind Organisationen gezwungen, eTMF-Lösungen zu übernehmen, die die Einhaltung dieser Standards gewährleisten. Die Integration von eTMF-Systemen ermöglicht den Echtzeitzugriff auf Studiendaten, wodurch Transparenz und Verantwortlichkeit erhöht werden. Dieser compliance-getriebene Ansatz mindert nicht nur die Risiken, die mit der Nichteinhaltung verbunden sind, sondern fördert auch das Vertrauen der Stakeholder. Das erwartete Marktwachstum mit einer prognostizierten durchschnittlichen jährlichen Wachstumsrate (CAGR) von 14,09 % von 2025 bis 2035 unterstreicht die Bedeutung der regulatorischen Ausrichtung bei der Einführung von eTMF-Systemen.
Technologische Fortschritte im Datenmanagement
Technologische Fortschritte spielen eine entscheidende Rolle bei der Gestaltung des Marktes für globale elektronische Trial Master File (eTMF) Systeme. Innovationen in der Cloud-Computing, künstlicher Intelligenz und Datenanalyse verändern die Art und Weise, wie klinische Studiendaten verwaltet und gespeichert werden. Diese Technologien ermöglichen es Organisationen, die Datenintegrität zu verbessern, Arbeitsabläufe zu optimieren und die Gesamteffizienz zu steigern. Mit der Weiterentwicklung der eTMF-Systeme bieten sie Funktionen wie automatisierte Dokumentenverfolgung und Echtzeit-Zusammenarbeit, die von Sponsoren klinischer Studien zunehmend nachgefragt werden. Die Wachstumsprognose des Marktes, mit einem erwarteten Anstieg von 1,02 Milliarden USD im Jahr 2024 auf 4,35 Milliarden USD bis 2035, spiegelt die Auswirkungen dieser technologischen Fortschritte auf die Branche wider.
Zunehmender Fokus auf patientenzentrierte Studien
Der globale Markt für elektronische Trial Master File (eTMF) Systeme erlebt einen Wandel hin zu patientenzentrierten klinischen Studien, der die Bedeutung von Patientenengagement und -erfahrung betont. Dieser Trend wird durch die Erkenntnis vorangetrieben, dass die Einbeziehung von Patienten in den Studienprozess zu besseren Ergebnissen und höheren Bindungsraten führen kann. eTMF-Systeme erleichtern das Management von patientenbezogenen Daten und Dokumentationen, sodass Sponsoren die Studien effektiv an die Bedürfnisse der Patienten anpassen können. Da Organisationen zunehmend patientenzentrierte Ansätze priorisieren, wird ein Anstieg der Nachfrage nach eTMF-Lösungen erwartet, was zum Wachstum des Marktes beiträgt. Die prognostizierte durchschnittliche jährliche Wachstumsrate (CAGR) von 14,09 % von 2025 bis 2035 deutet auf eine robuste Zukunft für eTMF-Systeme hin, die diesen Paradigmenwechsel unterstützen.
Einblicke in Marktsegmente
Einblicke in Komponenten von elektronischen Trial Master File (eTMF) Systemen
Die Marktsegmentierung der Electronic Trial Master File (eTMF) Systeme basiert auf Komponenten und umfasst Software und Dienstleistungen. Der Dienstleistungssektor dominierte den Markt im Jahr 2022 und wird voraussichtlich das am schnellsten wachsende Segment im Prognosezeitraum 2022-2030 sein. Ein Wachstumsfaktor für eTMF-Systeme im Bereich Dienstleistungen ist der Bedarf an besserer Zusammenarbeit und Zugänglichkeit der Dokumentation klinischer Studien. Dies ist mit dem Anstieg von Remote- und dezentralen klinischen Studien sowie dem Bedarf an Zusammenarbeit in multinationalen Studien zunehmend wichtig geworden.
Das eTMF-System von IQVIA ist darauf ausgelegt, diesem Bedarf gerecht zu werden, indem es eine zentralisierte, cloudbasierte Plattform zur Verwaltung von Dokumentationen klinischer Studien bereitstellt. Das System ermöglicht es den Teammitgliedern, Dokumente in Echtzeit von überall mit einer Internetverbindung zuzugreifen, was die Zusammenarbeit und Zugänglichkeit über geografische und zeitliche Grenzen hinweg erleichtert.
Im Januar 2021 kündigte Parexel, eine führende Auftragsforschungsorganisation (CRO), die Einführung seiner eTMF-Lösung an, die darauf abzielt, den Kunden zu helfen, die Dokumentation klinischer Studien auf eine zentralisierte, sichere und konforme Weise zu verwalten. Die Lösung ist Teil von Parexels Suite technologiegestützter Dienstleistungen für klinische Studien und soll der wachsenden Nachfrage nach eTMF-Lösungen bei biopharmazeutischen Unternehmen gerecht werden.
Einblicke in den Bereitstellungsmodus von elektronischen Trial Master File (eTMF) Systemen
Der Markt für elektronische Trial Master File (eTMF) Systeme wurde nach Bereitstellungsmodus in cloud-/webbasierte und lokale Systeme unterteilt. Das cloud-/webbasierte Segment dominierte den Markt im Jahr 2022 und wird voraussichtlich das am schnellsten wachsende Segment im Prognosezeitraum 2022-2030 sein. Die cloudbasierte Plattform des Systems eliminiert die Notwendigkeit für lokale Hardware und Software, was zu Kosteneinsparungen für Unternehmen führen kann.
Abbildung 1 Elektronische Trial Master File (eTMF) Systeme Markt, nach Bereitstellungsmodus, 2022 & 2030 (Milliarden USD)
Quellen: Sekundärforschung, Primärforschung, MRFR-Datenbank und Analystenbewertung
Regionale Einblicke
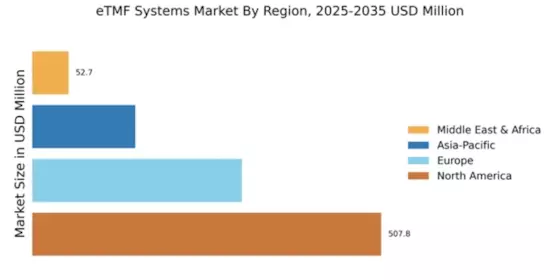
Nach Region bietet die Studie Einblicke in den Markt für Nordamerika, Europa, Asien-Pazifik und den Rest der Welt. Der Markt für elektronische Trial Master File (eTMF) Systeme in Nordamerika betrug 0,35 Milliarden USD im Jahr 2022 und wird voraussichtlich während des Studienzeitraums ein signifikantes CAGR-Wachstum aufweisen. Der nordamerikanische Markt wird von Faktoren wie der zunehmenden Auslagerung klinischer Studien, dem Wachstum der biopharmazeutischen Industrie und dem Bedarf an besserer Compliance und Datensicherheitsmaßnahmen angetrieben.
Es wird erwartet, dass der Markt in den kommenden Jahren weiter wächst, angetrieben von Faktoren wie dem Wachstum dezentraler und virtueller Studien, der Einführung cloudbasierter eTMF-Systeme und der steigenden Nachfrage nach Datenanalysen und -einblicken. Darüber hinaus hielt der Markt für elektronische Trial Master File (eTMF) Systeme in den USA den größten Marktanteil, und der Markt für elektronische Trial Master File (eTMF) Systeme in Kanada war der am schnellsten wachsende Markt in der nordamerikanischen Region.
Darüber hinaus sind die wichtigsten Länder, die in dem Marktbericht untersucht wurden, die USA, Kanada, Deutschland, Frankreich, das Vereinigte Königreich, Italien, Spanien, China, Japan, Indien, Australien, Südkorea und Brasilien.
Abbildung 2 Marktanteil der elektronischen Trial Master File (eTMF) Systeme nach Region 2022 (%)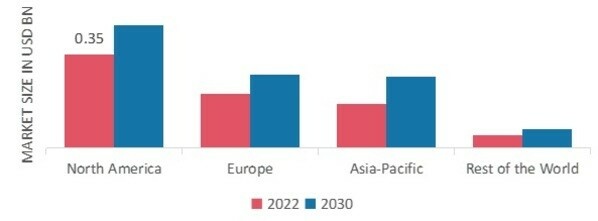
Quelle Sekundärforschung, Primärforschung, MRFR-Datenbank und Analystenbewertung
Der Markt für elektronische Trial Master File (eTMF) Systeme in Europa hat den zweitgrößten Marktanteil. Der Markt wird durch die steigende Nachfrage nach natürlichen und biologischen Produkten angetrieben. Der europäische Markt wird von Faktoren wie regulatorischer Compliance, steigender Nachfrage nach cloudbasierten Lösungen und dem Bedarf an besserer Zusammenarbeit und Datenaustausch zwischen den Beteiligten angetrieben. Es wird erwartet, dass der Markt in den kommenden Jahren weiter wächst, angetrieben von Faktoren wie der Einführung fortschrittlicher Analytik und KI-Technologien, einem erhöhten Fokus auf Patientenorientierung und dem Wachstum aufstrebender Märkte in Osteuropa.
Der Markt für elektronische Trial Master File (eTMF) Systeme im Asien-Pazifik-Raum wird voraussichtlich von 2022 bis 2030 mit der schnellsten CAGR wachsen. Der Markt wird von Faktoren wie dem Wachstum der biopharmazeutischen Industrie, der zunehmenden Auslagerung klinischer Studien und der Einführung fortschrittlicher Technologien angetrieben. Es wird erwartet, dass der Markt in den kommenden Jahren weiter wächst, angetrieben von Faktoren wie dem Wachstum aufstrebender Märkte, einem zunehmenden Fokus auf die Rekrutierung und Bindung von Patienten sowie der Einführung digitaler Gesundheitstechnologien.
Darüber hinaus hielt der Markt für elektronische Trial Master File (eTMF) Systeme in China den größten Marktanteil, und der Markt für elektronische Trial Master File (eTMF) Systeme in Indien war der am schnellsten wachsende Markt in der Region Asien-Pazifik.
Hauptakteure und Wettbewerbseinblicke
Wichtige Marktteilnehmer investieren viel Geld in Forschung und Entwicklung, um ihre Produktlinien zu erweitern, was dem Markt für elektronische Trial Master File (eTMF) Systeme weiteres Wachstum bescheren wird. Die Marktteilnehmer ergreifen auch eine Reihe strategischer Initiativen, um ihre weltweite Präsenz auszubauen, mit wichtigen Marktentwicklungen wie neuen Produkteinführungen, vertraglichen Vereinbarungen, Fusionen und Übernahmen, erhöhten Investitionen und der Zusammenarbeit mit anderen Organisationen. Wettbewerber in der Branche der elektronischen Trial Master File (eTMF) Systeme müssen kosteneffektive Produkte anbieten, um in einem zunehmend wettbewerbsintensiven und wachsenden Marktumfeld zu expandieren und zu überleben.
Eine der Hauptgeschäftsstrategien, die von Herstellern in der Branche der elektronischen Trial Master File (eTMF) Systeme angenommen wurde, um den Kunden zugute zu kommen und den Marktsektor zu erweitern, besteht darin, lokal zu produzieren, um die Betriebskosten zu senken. In den letzten Jahren hat die Branche der elektronischen Trial Master File (eTMF) Systeme innovative Produkte mit einigen der bedeutendsten Vorteile bereitgestellt. Zu den Hauptakteuren des Marktes für elektronische Trial Master File (eTMF) Systeme gehören Aurea, Covance Inc., Mastercontrol Inc., Oracle, Transperfect, Veeva Systems, ePharmaSolutions, Phlex, SureClinical Inc. und andere, die daran arbeiten, die Marktnachfrage durch Investitionen in Forschungs- und Entwicklungsaktivitäten zu steigern.
Aurea ist ein Softwareunternehmen, das eine Reihe von Produkten und Lösungen für Unternehmen in verschiedenen Branchen anbietet. Das Portfolio des Unternehmens umfasst Produkte für das Management von Kundenerfahrungen, Unternehmenskommunikation, Wissensmanagement und Zusammenarbeit. Im Zusammenhang mit eTMF-Systemen bietet Aurea ein Produkt namens Aurea Compliance Manager an, das eine cloudbasierte Plattform zur Verwaltung von regulatorischen Compliance- und Qualitätskontrollprozessen in klinischen Studien ist. Die Lösung umfasst Funktionen für das Dokumentenmanagement, die Prozessautomatisierung, Prüfpfade und Berichterstattung, die alle darauf ausgelegt sind, biopharmazeutischen Unternehmen zu helfen, ihre Compliance- und Qualitätskontrollaktivitäten effizienter und reibungsloser zu verwalten.
Die eTMF-Lösung von Aurea stammt aus dem Februar 2021, als das Unternehmen bekannt gab, dass es eine Partnerschaft mit Halozyme, einem Biotechnologieunternehmen, eingegangen ist, um die klinischen Studienprozesse von Halozyme mithilfe des Aurea Compliance Managers zu optimieren. Ziel der Partnerschaft war es, die Trial-Management-Prozesse von Halozyme zu verbessern, indem eine zentrale Plattform zur Verwaltung der regulatorischen Compliance-Aktivitäten bereitgestellt wird, die Daten genau und konsistent hält und das Risiko von Fehlern und Verzögerungen, die mit manuellen Prozessen verbunden sind, verringert. Die Partnerschaft mit Halozyme ist ein Beispiel dafür, wie die eTMF-Lösung von Aurea von biopharmazeutischen Unternehmen genutzt wird, um ihre klinischen Studienprozesse zu verbessern und die regulatorische Compliance sicherzustellen.
Da die Nachfrage nach eTMF-Systemen weiter wächst, wird erwartet, dass die Lösung von Aurea eine wichtige Rolle dabei spielt, Unternehmen zu helfen, ihre Compliance- und Qualitätskontrollaktivitäten effizienter und effektiver zu verwalten.
Covance Inc. ist eine Auftragsforschungsorganisation (CRO), die eine Reihe von Dienstleistungen für biopharmazeutische und medizinische Geräteunternehmen anbietet, darunter klinische Entwicklung, Labortests und Kommerzialisierungsdienste. Das Unternehmen ist in über 60 Ländern tätig und beschäftigt mehr als 50.000 Mitarbeiter. Im Zusammenhang mit eTMF-Systemen bietet Covance ein Produkt namens Xcellerate® eTMF an, das eine cloudbasierte Plattform zur Verwaltung und Speicherung von Dokumenten klinischer Studien auf eine konforme und sichere Weise ist.
Die Lösung umfasst Funktionen wie Dokumentenmanagement, Prüfpfade und Echtzeitberichterstattung, die alle darauf ausgelegt sind, klinischen Studien-Sponsoren zu helfen, ihre Studienunterlagen effizienter und effektiver zu verwalten. Eine aktuelle Nachricht zu Covances eTMF-Lösung stammt aus dem Oktober 2020, als das Unternehmen bekannt gab, dass es eine neue Version von Xcellerate® eTMF auf den Markt gebracht hat. Die neue Version beinhaltete mehrere Verbesserungen, wie verbesserte Dokumentenmanagementfähigkeiten, erweiterte Prüfpfade und Echtzeitüberwachung der Vollständigkeit und Compliance von Dokumenten. Die neue Version beinhaltete auch Integrationen mit anderen Covance-Produkten, wie Xcellerate® Monitoring, das eine risikobasierte Überwachungslösung ist.
Zu den wichtigsten Unternehmen im eTMF-Systeme Markt-Markt gehören






Branchenentwicklungen
- Q2 2024: Veeva Systems kündigt die Veröffentlichung von Veeva Vault eTMF 23R1 mit erweiterten KI-Funktionen an Veeva Systems hat ein großes Update seiner Vault eTMF-Plattform veröffentlicht, das fortschrittliche KI-gestützte Dokumentenklassifizierung und automatisierte Compliance-Funktionen einführt, um das Management klinischer Studien zu optimieren.
- Q2 2024: TransPerfect Life Sciences startet Trial Interactive eTMF Connect TransPerfect Life Sciences hat Trial Interactive eTMF Connect vorgestellt, eine neue cloudbasierte Plattform, die darauf abzielt, die Zusammenarbeit und die regulatorische Compliance für globale klinische Studien zu verbessern.
- Q3 2024: Phlexglobal geht Partnerschaft mit Medidata ein, um eTMF- und klinische Studienplattformen zu integrieren Phlexglobal gab eine strategische Partnerschaft mit Medidata bekannt, um seine eTMF-Lösung mit Medidata’s klinischem Studienmanagementsystem zu integrieren, mit dem Ziel, die Dateninteroperabilität und die Überwachung von Studien zu verbessern.
- Q3 2024: Veeva Systems ernennt neuen Chief Technology Officer zur Leitung der eTMF-Innovation Veeva Systems hat Dr. Lisa Chen zur CTO ernannt und ihr die Aufgabe übertragen, die Innovation in den eTMF- und klinischen Studienmanagement-Produktlinien des Unternehmens voranzutreiben.
- Q4 2024: IQVIA gewinnt mehrjährigen eTMF-Vertrag mit einem der 10 größten Pharmaunternehmen IQVIA sicherte sich einen mehrjährigen Vertrag zur Bereitstellung seiner eTMF-Plattform für die klinischen Studienoperationen eines führenden globalen Pharmaunternehmens und erweitert damit seine Präsenz im eTMF-Sektor.
- Q4 2024: WCG Clinical startet Next-Gen eTMF-Plattform für dezentrale Studien WCG Clinical hat eine Next-Gen eTMF-Plattform eingeführt, die auf dezentrale und hybride klinische Studien zugeschnitten ist und verbesserte Fernzugriffs- und Compliance-Überwachungsfunktionen bietet.
- Q1 2025: MasterControl kündigt strategische Partnerschaft mit Oracle Health zur eTMF-Integration an MasterControl hat eine strategische Partnerschaft mit Oracle Health geschlossen, um seine eTMF-Lösung in das Gesundheitsdaten-Ökosystem von Oracle zu integrieren, mit dem Ziel, regulatorische Einreichungen zu optimieren.
- Q1 2025: Veeva Systems erweitert europäische Aktivitäten mit neuem eTMF-Rechenzentrum in Deutschland Veeva Systems hat ein neues Rechenzentrum in Deutschland eröffnet, um seine europäischen eTMF-Kunden zu unterstützen und die Datensicherheit sowie die regulatorische Compliance für klinische Studien in der EU zu verbessern.
- Q2 2025: Phlexglobal erhält ISO 27001-Zertifizierung für eTMF-Plattform Die eTMF-Plattform von Phlexglobal hat die ISO 27001-Zertifizierung erreicht, was das Engagement des Unternehmens für Informationssicherheit und regulatorische Compliance im Dokumentenmanagement klinischer Studien demonstriert.
- Q2 2025: Medidata startet KI-gesteuertes eTMF-Analyse-Toolkit Medidata hat ein neues KI-gesteuertes Analyse-Toolkit für seine eTMF-Plattform veröffentlicht, das Sponsoren und CROs ermöglicht, Echtzeiteinblicke in die Vollständigkeit und Compliance von Studienunterlagen zu erhalten.
- Q3 2025: TransPerfect Life Sciences gewinnt eTMF-Vertrag mit globalem Biotech-Unternehmen TransPerfect Life Sciences sicherte sich einen Vertrag zur Bereitstellung seiner eTMF-Lösung für die bevorstehenden Phase-III-Studien eines globalen Biotech-Unternehmens.
- Q3 2025: WCG Clinical ernennt neuen VP für Produktentwicklung im Bereich eTMF-Lösungen WCG Clinical gab die Ernennung von Mark Evans zum Vice President of Product bekannt, der für die Leitung der Entwicklung und Expansion der eTMF-Angebote des Unternehmens verantwortlich ist.
Zukunftsaussichten
eTMF-Systeme Markt Zukunftsaussichten
Der Markt für elektronische Trial Master File (eTMF) Systeme wird voraussichtlich von 2025 bis 2035 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 14,12 % wachsen, angetrieben durch technologische Fortschritte und Anforderungen an die Einhaltung von Vorschriften.
Neue Möglichkeiten liegen in:
- Entwickeln Sie KI-gesteuerte Analysetools für ein verbessertes Datenmanagement. Erweitern Sie cloudbasierte eTMF-Lösungen für den Fernzugriff. Investieren Sie in Cybersicherheitsmaßnahmen zum Schutz sensibler Studiendaten.
Bis 2035 wird der eTMF-Markt voraussichtlich robust sein und ein erhebliches Wachstum sowie Innovationen widerspiegeln.
Marktsegmentierung
Elektronische Trial Master File (eTMF) Systemkomponentenübersicht
- Software
- Dienstleistungen
Elektronisches Trial Master File (eTMF) Systeme Endbenutzerausblick
- [ "Pharma- und Biotechnologieunternehmen", "Auftragsforschungsorganisationen", "Sonstige" ]
Elektronische Trial Master File (eTMF) Systeme Bereitstellungsmodus Ausblick
- [ "Cloud/Web-basiert.webp", "Vor-Ort" ]
Berichtsumfang
Bericht über den Umfang der elektronischen Trial Master File (eTMF) Systeme
| Berichtsattribut/Metrik | Details |
| Marktgröße 2024 | 1,02 (Milliarden USD) |
| Marktgröße 2025 | 1,16 (Milliarden USD) |
| Marktgröße 2035 | 4,34 (Milliarden USD) |
| Durchschnittliche jährliche Wachstumsrate (CAGR) | 14,12% (2025 - 2035) |
| Berichtsabdeckung | Umsatzprognose, Wettbewerbslandschaft, Wachstumsfaktoren und Trends |
| Basisjahr | 2024 |
| Marktprognosezeitraum | 2025 - 2035 |
| Historische Daten | 2020 - 2024 |
| Berichtsabdeckung | Umsatzprognose, Wettbewerbslandschaft des Marktes, Wachstumsfaktoren und Trends |
| Abgedeckte Segmente | Produktart, Zustand, Endbenutzer und Region |
| Abgedeckte Geografien | Nordamerika, Europa, Asien-Pazifik und Rest der Welt |
| Abgedeckte Länder | Die USA, Kanada, Deutschland, Frankreich, Großbritannien, Italien, Spanien, China, Japan, Indien, Australien, Südkorea und Brasilien |
| Wichtige Unternehmen, die profiliert werden | Aurea, Covance Inc., Mastercontrol Inc., Oracle, Transperfect, Veeva Systems, ePharmaSolutions, Phlex, SureClinical Inc. und andere |
| Wichtige Marktchancen | Regulatorische Compliance, Effizienz und Kosteneinsparungen |
| Wichtige Marktdynamiken | Steigende Akzeptanz elektronischer Aufzeichnungen |
Markt-Highlights
FAQs
Wie wird das voraussichtliche Wachstum des Marktes für elektronische Trial Master File Systeme aussehen?
Der Markt für elektronische Trial Master File Systeme wird voraussichtlich einen Anstieg des Gesamtmarktwerts um 4,34 Milliarden USD über einen definierten Prognosezeitraum von 2025 bis 2035 verzeichnen. Er wird durch Faktoren wie Nachfragetrends, technologische Fortschritte, regulatorische Änderungen und geografische Expansion angetrieben.
Wie groß ist der Markt für elektronische Trial Master File Systeme?
Der Markt für elektronische Trial Master File Systeme wurde im Jahr 2024 auf etwa 1,02 Milliarden USD geschätzt. Diese Zahl wird bis 2035 auf 4,34 Milliarden USD ansteigen und alle Regionen (Amerika, Europa, Asien, MEA und ROW) abdecken, wobei die Segmente / Dienstleistungen / Vertriebskanäle im Fokus stehen.
Was ist die CAGR des Marktes für elektronische Trial Master File Systeme?
Der Markt für elektronische Trial Master File Systeme wird voraussichtlich von 2025 bis 2035 mit einer CAGR von 14,12 % wachsen.
Wie viel wird der Markt für elektronische Trial Master File Systeme bis 2035 wert sein?
Der Markt für elektronische Trial Master File Systeme wird bis Ende 2035 voraussichtlich einen Wert von 4,34 Milliarden USD erreichen, was auf ein Wachstum zurückzuführen ist, das durch Nutzung, Technologie und globale Anforderungen vorangetrieben wird.
Wie wird sich der Markt für elektronische Trial Master File Systeme in den nächsten 10 Jahren entwickeln?
Im Laufe der nächsten 10 Jahre wird erwartet, dass sich der Markt für elektronische Trial Master File Systeme von 1,02 Milliarden USD auf 4,34 Milliarden USD entwickeln wird, angetrieben durch die Einführung fortschrittlicher Technologien, demografische Trends und regulatorische Genehmigungen, mit potenziellen Herausforderungen von 2025 bis 2035.
Welche Region hatte den größten Marktanteil im Markt für Electronic Trial Master File (eTMF) Systeme?
Nordamerika hatte den größten Anteil am Markt.
Bitte füllen Sie das folgende Formular aus, um ein kostenloses Muster dieses Berichts zu erhalten
Customer Stories

“This is really good guys. Excellent work on a tight deadline. I will continue to use you going forward and recommend you to others. Nice job”

“Thanks. It’s been a pleasure working with you, please use me as reference with any other Intel employees.”

“Thanks for sending the report it gives us a good global view of the Betaïne market.”

“Thank you, this will be very helpful for OQS.”

“We found the report very insightful! we found your research firm very helpful. I'm sending this email to secure our future business.”

“I am very pleased with how market segments have been defined in a relevant way for my purposes (such as "Portable Freezers & refrigerators" and "last-mile"). In general the report is well structured. Thanks very much for your efforts.”

“I have been reading the first document or the study, ,the Global HVAC and FP market report 2021 till 2026. Must say, good info! I have not gone in depth at all parts, but got a good indication of the data inside!”

“We got the report in time, we really thank you for your support in this process. I also thank to all of your team as they did a great job.”
