
Marché des systèmes eTMF
Rapport de recherche sur le marché des systèmes de dossier maître d'essai électronique (eTMF) Informations par composant (logiciel et services), par mode de déploiement (cloud/basé sur le web et sur site), par utilisateur final (entreprises pharmaceutiques et biotechnologiques, organisations de recherche sous contrat et autres) et par région (Amérique du Nord, Europe, Asie-Pacifique et reste du monde) – Prévisions du marché jusqu'en 2035
Marché des systèmes eTMF Tendances
Adoption croissante des dossiers électroniques pour stimuler la croissance du marché
Les industries pharmaceutiques et biotechnologiques sont fortement réglementées, et les systèmes eTMF offrent aux entreprises un moyen de gérer leur documentation d'essai clinique en conformité avec des réglementations telles que le 21 CFR Part 11. Cela a été un facteur de croissance significatif pour les systèmes eTMF, car les entreprises cherchent à éviter le risque de pénalités pour non-conformité et à rationaliser leurs processus de reporting réglementaire.
Les systèmes eTMF permettent une meilleure collaboration et accessibilité de la documentation des essais cliniques, car les membres de l'équipe peuvent accéder aux documents en temps réel depuis n'importe où avec une connexion Internet. Cela est devenu de plus en plus important avec l'essor des essais cliniques à distance et décentralisés, ainsi que le besoin de collaboration dans les essais multinationaux. Les systèmes eTMF peuvent être intégrés à d'autres systèmes d'essai clinique, tels que la capture de données électroniques (EDC) et les systèmes de gestion des essais cliniques (CTMS), pour fournir une solution plus complète et rationalisée pour la gestion des essais cliniques.
Cette intégration est devenue un facteur de croissance pour les systèmes eTMF, car les entreprises cherchent à unifier leurs processus de gestion des essais cliniques et des données.
La tendance générale vers les dossiers électroniques dans l'industrie de la santé a également été un facteur de croissance pour les systèmes eTMF. À mesure que de plus en plus d'entreprises passent aux dossiers électroniques pour leur documentation d'essai clinique, les systèmes eTMF sont devenus un choix naturel pour gérer ces dossiers.
Marché des systèmes eTMF conducteurs
Mondialisation de la recherche clinique
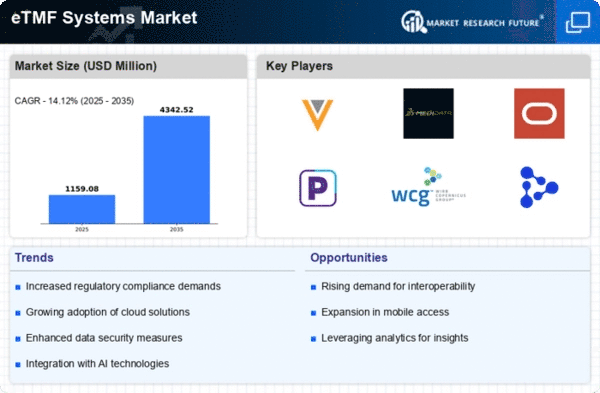
La mondialisation de la recherche clinique influence considérablement le marché mondial des systèmes de fichiers maîtres électroniques d'essai (eTMF). À mesure que les entreprises pharmaceutiques étendent leurs opérations au-delà des frontières, le besoin de documentation et de gestion des données standardisées devient primordial. Les systèmes eTMF fournissent une plateforme centralisée pour gérer les documents d'essai provenant de plusieurs régions, garantissant la cohérence et la conformité avec des exigences réglementaires diverses. Cette tendance à la mondialisation améliore non seulement la collaboration entre les équipes de recherche internationales, mais accélère également le processus de développement de médicaments. La croissance anticipée du marché, passant de 1,02 milliard USD en 2024 à 4,35 milliards USD d'ici 2035, souligne le rôle critique des systèmes eTMF dans la facilitation des essais cliniques mondiaux.
Conformité réglementaire et normalisation
La conformité réglementaire reste un moteur essentiel pour le marché mondial des systèmes de dossier maître d'essai électronique (eTMF). Alors que les organismes de réglementation imposent des directives strictes pour la documentation des essais cliniques, les organisations sont contraintes d'adopter des solutions eTMF qui garantissent le respect de ces normes. L'intégration des systèmes eTMF facilite l'accès en temps réel aux données d'essai, améliorant ainsi la transparence et la responsabilité. Cette approche axée sur la conformité non seulement atténue les risques associés à la non-conformité, mais favorise également la confiance entre les parties prenantes. La croissance anticipée du marché, avec un taux de croissance annuel composé (CAGR) projeté de 14,09 % de 2025 à 2035, souligne l'importance de l'alignement réglementaire dans l'adoption des systèmes eTMF.
Demande croissante pour les essais cliniques
Le marché mondial des systèmes de fichiers maîtres d'essai électroniques (eTMF) connaît une augmentation de la demande pour les essais cliniques, alimentée par le besoin d'une gestion efficace des données et de conformité réglementaire. Alors que le nombre d'essais cliniques continue d'augmenter, les organisations adoptent de plus en plus les systèmes eTMF pour rationaliser les processus et améliorer la collaboration entre les parties prenantes. En 2024, le marché est évalué à 1,02 milliard USD, reflétant la reconnaissance croissante des systèmes eTMF comme des outils essentiels pour la gestion de la documentation des essais. Cette tendance devrait se poursuivre, avec des projections indiquant une croissance du marché à 4,35 milliards USD d'ici 2035, soulignant le rôle critique des systèmes eTMF dans le paysage en évolution de la recherche clinique.
Avancées technologiques dans la gestion des données
Les avancées technologiques jouent un rôle crucial dans la formation du marché mondial des systèmes de fichiers maîtres d'essai électronique (eTMF). Les innovations en matière de cloud computing, d'intelligence artificielle et d'analyse de données transforment la manière dont les données des essais cliniques sont gérées et stockées. Ces technologies permettent aux organisations d'améliorer l'intégrité des données, de rationaliser les flux de travail et d'améliorer l'efficacité globale. À mesure que les systèmes eTMF évoluent, ils offrent des fonctionnalités telles que le suivi automatisé des documents et la collaboration en temps réel, qui sont de plus en plus recherchées par les sponsors d'essais cliniques. La trajectoire de croissance du marché, avec une augmentation prévue de 1,02 milliard USD en 2024 à 4,35 milliards USD d'ici 2035, reflète l'impact de ces avancées technologiques sur l'industrie.
Accent croissant sur les essais centrés sur le patient
Le marché mondial des systèmes de fichiers maîtres d'essai électroniques (eTMF) connaît un changement vers des essais cliniques centrés sur le patient, ce qui souligne l'importance de l'engagement et de l'expérience des patients. Cette tendance est motivée par la reconnaissance que l'implication des patients dans le processus d'essai peut conduire à de meilleurs résultats et à des taux de rétention plus élevés. Les systèmes eTMF facilitent la gestion des données et de la documentation liées aux patients, permettant aux sponsors d'adapter les essais pour répondre efficacement aux besoins des patients. À mesure que les organisations privilégient de plus en plus les approches centrées sur le patient, la demande de solutions eTMF devrait augmenter, contribuant à la croissance du marché. Le taux de croissance annuel composé (CAGR) projeté de 14,09 % de 2025 à 2035 indique un avenir solide pour les systèmes eTMF dans le soutien à ce changement de paradigme.
Aperçu des segments de marché
Aperçus des composants des systèmes de Dossier Maître d'Essai Électronique (eTMF)
La segmentation du marché des systèmes de dossier maître d'essai électronique (eTMF), basée sur les composants, comprend les logiciels et les services. Le segment des services a dominé le marché en 2022 et devrait être le segment à la croissance la plus rapide pendant la période de prévision, 2022-2030. Un facteur de croissance pour les systèmes eTMF dans les services est le besoin d'une meilleure collaboration et d'une accessibilité des documents d'essai clinique. Cela est devenu de plus en plus important avec l'essor des essais cliniques à distance et décentralisés, ainsi que le besoin de collaboration dans les essais multinationaux.
Le système eTMF d'IQVIA est conçu pour répondre à ce besoin en fournissant une plateforme centralisée et basée sur le cloud pour la gestion de la documentation des essais cliniques. Le système permet aux membres de l'équipe d'accéder aux documents en temps réel depuis n'importe où avec une connexion Internet, facilitant la collaboration et l'accessibilité à travers les géographies et les fuseaux horaires.
En janvier 2021, Parexel, un leader dans le domaine des organisations de recherche sous contrat (CRO), a annoncé le lancement de sa solution eTMF, conçue pour aider les clients à gérer la documentation des essais cliniques de manière centralisée, sécurisée et conforme. La solution fait partie de l'ensemble des services technologiques de Parexel pour les essais cliniques et vise à répondre à la demande croissante de solutions eTMF parmi les entreprises biopharmaceutiques.
Aperçus sur le mode de déploiement des systèmes de Dossier Maître d'Essai Électronique (eTMF)
Le marché des systèmes de dossier maître d'essai électronique (eTMF) a été divisé par mode de déploiement en cloud/basé sur le web et sur site. Le segment cloud/basé sur le web a dominé le marché en 2022 et devrait être le segment à la croissance la plus rapide pendant la période de prévision, 2022-2030. La plateforme cloud du système élimine le besoin de matériel et de logiciels sur site, ce qui peut entraîner des économies de coûts pour les entreprises.
Figure 1 Systèmes de Dossier Maître d'Essai Électronique (eTMF), par Mode de Déploiement, 2022 & 2030 (milliards USD)
Recherche secondaire source, recherche primaire, base de données MRFR et revue des analystes
Aperçu régional
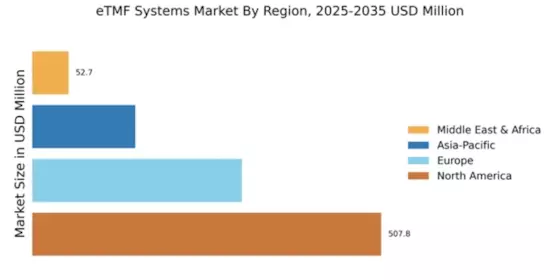
Par région, l'étude fournit des informations sur le marché en Amérique du Nord, en Europe, en Asie-Pacifique et dans le reste du monde. Le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) en Amérique du Nord a représenté 0,35 milliard USD en 2022 et devrait afficher une croissance significative du taux de croissance annuel composé (CAGR) pendant la période d'étude. Le marché nord-américain est soutenu par des facteurs tels que l'augmentation de l'externalisation des essais cliniques, la croissance de l'industrie biopharmaceutique et le besoin de meilleures mesures de conformité et de sécurité des données.
Le marché devrait continuer à croître dans les années à venir, soutenu par des facteurs tels que la croissance des essais décentralisés et virtuels, l'adoption de systèmes eTMF basés sur le cloud et la demande croissante d'analytique et d'informations. De plus, le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) aux États-Unis détenait la plus grande part de marché, et le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) au Canada était le marché à la croissance la plus rapide dans la région nord-américaine.
De plus, les principaux pays étudiés dans le rapport de marché sont les États-Unis, le Canada, l'Allemagne, la France, le Royaume-Uni, l'Italie, l'Espagne, la Chine, le Japon, l'Inde, l'Australie, la Corée du Sud et le Brésil.
Figure 2 PART DE MARCHÉ DES SYSTÈMES DE FICHIERS MAÎTRES D'ESSAI ÉLECTRONIQUES (eTMF) PAR RÉGION 2022 (%)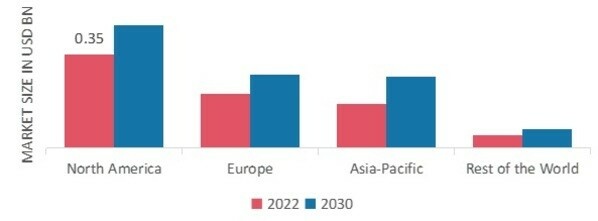
Source : Recherche secondaire, recherche primaire, base de données MRFR et revue des analystes
Le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) en Europe représente la deuxième plus grande part de marché. Le marché est soutenu par la demande croissante de produits naturels et biologiques. Le marché européen est soutenu par des facteurs tels que la conformité réglementaire, la demande croissante de solutions basées sur le cloud et le besoin d'une meilleure collaboration et d'un meilleur partage des données entre les parties prenantes. Le marché devrait continuer à croître dans les années à venir, soutenu par des facteurs tels que l'adoption d'analytique avancée et de technologies d'IA, un accent accru sur la centration sur le patient et la croissance des marchés émergents en Europe de l'Est.
Le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) en Asie-Pacifique devrait croître au taux de croissance annuel composé (CAGR) le plus rapide de 2022 à 2030. Le marché est soutenu par des facteurs tels que la croissance de l'industrie biopharmaceutique, l'augmentation de l'externalisation des essais cliniques et l'adoption de technologies avancées. Le marché devrait continuer à croître dans les années à venir, soutenu par des facteurs tels que la croissance des marchés émergents, un accent accru sur le recrutement et la rétention des patients, et l'adoption de technologies de santé numérique.
De plus, le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) en Chine détenait la plus grande part de marché, et le marché des systèmes de fichiers maîtres d'essai électroniques (eTMF) en Inde était le marché à la croissance la plus rapide dans la région Asie-Pacifique.
Acteurs clés et aperçu concurrentiel
Les principaux acteurs du marché dépensent beaucoup d'argent en R&D pour élargir leurs gammes de produits, ce qui aidera le marché des systèmes de dossier maître d'essai électronique (eTMF) à croître encore plus. Les participants au marché prennent également une série d'initiatives stratégiques pour accroître leur empreinte mondiale, avec des développements clés sur le marché tels que le lancement de nouveaux produits, des accords contractuels, des fusions et acquisitions, des investissements accrus et des collaborations avec d'autres organisations. Les concurrents de l'industrie des systèmes de dossier maître d'essai électronique (eTMF) doivent offrir des produits rentables pour se développer et survivre dans un environnement de marché de plus en plus compétitif et en croissance.
Une des principales stratégies commerciales adoptées par les fabricants de l'industrie des systèmes de dossier maître d'essai électronique (eTMF) pour bénéficier aux clients et élargir le secteur du marché est de fabriquer localement pour réduire les coûts d'exploitation. Ces dernières années, l'industrie des systèmes de dossier maître d'essai électronique (eTMF) a fourni des produits innovants avec certains des avantages les plus significatifs. Les principaux acteurs du marché des systèmes de dossier maître d'essai électronique (eTMF) tels qu'Aurea, Covance Inc., Mastercontrol Inc., Oracle, Transperfect, Veeva Systems, ePharmaSolutions, Phlex, SureClinical Inc., et d'autres travaillent à accroître la demande du marché en investissant dans des activités de recherche et développement.
Aurea est une entreprise de logiciels qui propose une gamme de produits et de solutions pour les entreprises de divers secteurs. Le portefeuille de l'entreprise comprend des produits pour la gestion de l'expérience client, la messagerie d'entreprise, la gestion des connaissances et la collaboration. En ce qui concerne les systèmes eTMF, Aurea propose un produit appelé Aurea Compliance Manager, qui est une plateforme basée sur le cloud pour gérer la conformité réglementaire et les processus de contrôle qualité dans les essais cliniques. La solution comprend des fonctionnalités de gestion documentaire, d'automatisation des processus, de pistes de vérification et de reporting, toutes conçues pour aider les entreprises biopharmaceutiques à gérer leurs activités de conformité et de contrôle qualité de manière plus efficace et rationalisée.
La solution eTMF d'Aurea date de février 2021, lorsque l'entreprise a annoncé qu'elle s'était associée à Halozyme, une entreprise de biotechnologie, pour rationaliser les processus d'essai clinique de Halozyme en utilisant Aurea Compliance Manager. Le partenariat visait à améliorer les processus de gestion des essais de Halozyme en fournissant une plateforme centralisée pour gérer les activités de conformité réglementaire, garantir l'exactitude et la cohérence des données, et réduire le risque d'erreurs et de retards associés aux processus manuels. Le partenariat avec Halozyme est un exemple de la manière dont la solution eTMF d'Aurea est utilisée par les entreprises biopharmaceutiques pour améliorer leurs processus d'essai clinique et garantir la conformité réglementaire.
Alors que la demande pour les systèmes eTMF continue de croître, la solution d'Aurea devrait jouer un rôle important pour aider les entreprises à gérer leurs activités de conformité et de contrôle qualité de manière plus efficace et efficiente.
Covance Inc est une organisation de recherche sous contrat (CRO) qui fournit une gamme de services aux entreprises biopharmaceutiques et de dispositifs médicaux, y compris le développement clinique, les tests en laboratoire et les services de commercialisation. L'entreprise opère dans plus de 60 pays et compte plus de 50 000 employés. En ce qui concerne les systèmes eTMF, Covance propose un produit appelé Xcellerate® eTMF, qui est une plateforme basée sur le cloud pour gérer et stocker les documents d'essai clinique de manière conforme et sécurisée.
La solution comprend des fonctionnalités telles que la gestion documentaire, les pistes de vérification et le reporting en temps réel, toutes conçues pour aider les sponsors d'essais cliniques à gérer leur documentation d'essai de manière plus efficace et efficiente. Une nouvelle récente liée à la solution eTMF de Covance date d'octobre 2020, lorsque l'entreprise a annoncé qu'elle avait lancé une nouvelle version de Xcellerate® eTMF. La nouvelle version comprenait plusieurs améliorations, telles que des capacités de gestion documentaire améliorées, des pistes de vérification renforcées et un suivi en temps réel de l'exhaustivité et de la conformité des documents. La nouvelle version comprenait également des intégrations avec d'autres produits Covance, tels que Xcellerate® Monitoring, qui est une solution de surveillance basée sur les risques.
Les principales entreprises du marché Marché des systèmes eTMF incluent






Développements de l'industrie
- Q2 2024 : Veeva Systems Annonce la Sortie de Veeva Vault eTMF 23R1 avec des Capacités AI Améliorées Veeva Systems a lancé une mise à jour majeure de sa plateforme Vault eTMF, introduisant une classification de documents avancée alimentée par l'IA et des fonctionnalités de conformité automatisées pour rationaliser la gestion des essais cliniques.
- Q2 2024 : TransPerfect Life Sciences Lance Trial Interactive eTMF Connect TransPerfect Life Sciences a dévoilé Trial Interactive eTMF Connect, une nouvelle plateforme cloud conçue pour améliorer la collaboration et la conformité réglementaire pour les essais cliniques mondiaux.
- Q3 2024 : Phlexglobal S'associe à Medidata pour Intégrer les Plateformes eTMF et d'Essais Cliniques Phlexglobal a annoncé un partenariat stratégique avec Medidata pour intégrer sa solution eTMF avec le système de gestion des essais cliniques de Medidata, visant à améliorer l'interopérabilité des données et la supervision des essais.
- Q3 2024 : Veeva Systems Nomme un Nouveau Directeur Technique pour Diriger l'Innovation eTMF Veeva Systems a nommé Dr. Lisa Chen au poste de CTO, lui confiant la mission de stimuler l'innovation dans les lignes de produits eTMF et de gestion des essais cliniques de l'entreprise.
- Q4 2024 : IQVIA Remporte un Contrat eTMF de Plusieurs Années avec une Entreprise Pharmaceutique du Top 10 IQVIA a obtenu un contrat pluriannuel pour fournir sa plateforme eTMF aux opérations d'essais cliniques d'une entreprise pharmaceutique mondiale de premier plan, élargissant son empreinte dans le secteur eTMF.
- Q4 2024 : WCG Clinical Lance une Plateforme eTMF de Nouvelle Génération pour les Essais Décentralisés WCG Clinical a introduit une plateforme eTMF de nouvelle génération adaptée aux essais cliniques décentralisés et hybrides, offrant un accès à distance amélioré et un suivi de conformité.
- Q1 2025 : MasterControl Annonce un Partenariat Stratégique avec Oracle Health pour l'Intégration eTMF MasterControl a conclu un partenariat stratégique avec Oracle Health pour intégrer sa solution eTMF avec l'écosystème de données de santé d'Oracle, visant à rationaliser les soumissions réglementaires.
- Q1 2025 : Veeva Systems Élargit ses Opérations Européennes avec un Nouveau Centre de Données eTMF en Allemagne Veeva Systems a ouvert un nouveau centre de données en Allemagne pour soutenir ses clients eTMF européens, renforçant la sécurité des données et la conformité réglementaire pour les essais cliniques basés dans l'UE.
- Q2 2025 : Phlexglobal Obtient la Certification ISO 27001 pour sa Plateforme eTMF La plateforme eTMF de Phlexglobal a obtenu la certification ISO 27001, démontrant son engagement envers la sécurité de l'information et la conformité réglementaire dans la gestion des documents d'essais cliniques.
- Q2 2025 : Medidata Lance une Suite d'Analytique eTMF Alimentée par l'IA Medidata a publié une nouvelle suite d'analytique alimentée par l'IA pour sa plateforme eTMF, permettant aux sponsors et aux CRO d'obtenir des informations en temps réel sur l'exhaustivité et la conformité des documents d'essai.
- Q3 2025 : TransPerfect Life Sciences Remporte un Contrat eTMF avec une Entreprise Biotech Mondiale TransPerfect Life Sciences a obtenu un contrat pour fournir sa solution eTMF pour les prochains essais cliniques de Phase III d'une entreprise biotech mondiale.
- Q3 2025 : WCG Clinical Nomme un Nouveau VP Produit pour les Solutions eTMF WCG Clinical a annoncé la nomination de Mark Evans au poste de Vice-Président Produit, responsable de diriger le développement et l'expansion des offres eTMF de l'entreprise.
Perspectives d'avenir
Marché des systèmes eTMF Perspectives d'avenir
Le marché des systèmes de dossier maître d'essai électronique (eTMF) devrait croître à un taux de croissance annuel composé (CAGR) de 14,12 % entre 2025 et 2035, soutenu par les avancées technologiques et les exigences de conformité réglementaire.
De nouvelles opportunités résident dans :
- Développer des outils d'analyse pilotés par l'IA pour une gestion des données améliorée. Élargir les solutions eTMF basées sur le cloud pour un accès à distance. Investir dans des mesures de cybersécurité pour protéger les données sensibles des essais.
D'ici 2035, le marché de l'eTMF devrait être robuste, reflétant une croissance et une innovation substantielles.
Segmentation du marché
Perspectives des composants des systèmes de dossier maître d'essai électronique (eTMF)
- Logiciel
- Services
Systèmes de Dossier Maître d'Essai Électronique (eTMF) Perspectives des Utilisateurs Finaux
- [ "Entreprises pharmaceutiques et biopharmaceutiques", "Organisations de recherche sous contrat", "Autres" ]
Perspectives sur le mode de déploiement des systèmes de dossier maître d'essai électronique (eTMF)
- ["Cloud/Web-Based.webp","Sur site"]
Portée du rapport
Portée du rapport sur les systèmes de dossier maître d'essai électronique (eTMF)
| Attribut/Métrique du rapport | Détails |
| Taille du marché 2024 | 1,02 (milliards USD) |
| Taille du marché 2025 | 1,16 (milliards USD) |
| Taille du marché 2035 | 4,34 (milliards USD) |
| Taux de croissance annuel composé (CAGR) | 14,12 % (2025 - 2035) |
| Couverture du rapport | Prévisions de revenus, paysage concurrentiel, facteurs de croissance et tendances |
| Année de base | 2024 |
| Période de prévision du marché | 2025 - 2035 |
| Données historiques | 2020 - 2024 |
| Couverture du rapport | Prévisions de revenus, paysage concurrentiel du marché, facteurs de croissance et tendances |
| Segments couverts | Type de produit, condition, utilisateur final et région |
| Géographies couvertes | Amérique du Nord, Europe, Asie-Pacifique et reste du monde |
| Pays couverts | Les États-Unis, Canada, Allemagne, France, Royaume-Uni, Italie, Espagne, Chine, Japon, Inde, Australie, Corée du Sud et Brésil |
| Principales entreprises profilées | Aurea, Covance Inc., Mastercontrol Inc., Oracle, Transperfect, Veeva Systems, ePharmaSolutions, Phlex, SureClinical Inc., et autres |
| Principales opportunités de marché | Conformité réglementaire, efficacité et économies de coûts |
| Dynamiques clés du marché | Adoption croissante des dossiers électroniques |
Faits saillants du marché
FAQs
Quelle est la croissance projetée du marché des systèmes de fichiers maîtres d'essai électroniques ?
Le marché des systèmes de fichiers maîtres d'essai électroniques devrait connaître une augmentation de la valeur totale du marché de 4,34 milliards USD sur une période de prévision définie de 2025 à 2035. Il est soutenu par des facteurs tels que les tendances de la demande, les avancées technologiques, les changements réglementaires et l'expansion géographique.
Quelle est la taille du marché des systèmes de fichiers maîtres d'essai électroniques ?
La taille du marché des systèmes électroniques de fichiers maîtres d'essai était évaluée à environ 1,02 milliard USD en 2024. Ce chiffre atteindra 4,34 milliards USD couvrant toutes les régions (Amérique, Europe, Asie, MEA et ROW), en se concentrant sur ses segments / services / canaux de distribution jusqu'en 2035.
Quel est le TCAC du marché des systèmes de fichiers maîtres d'essai électroniques ?
Le marché des systèmes de fichiers maîtres d'essai électroniques devrait croître à un TCAC de 14,12 % entre 2025 et 2035.
Quelle sera la valeur du marché des systèmes de fichiers maîtres d'essai électroniques d'ici 2035 ?
Le marché des systèmes électroniques de fichiers maîtres d'essai devrait atteindre 4,34 milliards USD, reflétant une croissance tirée par l'utilisation, la technologie et les demandes mondiales d'ici la fin de 2035.
Comment le marché des systèmes de dossiers maîtres d'essai électroniques se comportera-t-il au cours des 10 prochaines années ?
Au cours des 10 prochaines années, le marché des systèmes électroniques de fichiers maîtres d'essai devrait passer de 1,02 milliard USD à 4,34 milliards USD, entraîné par l'adoption de technologies avancées, des tendances démographiques, des approbations réglementaires, avec des vents contraires potentiels de 2025 à 2035.
Quelle région détenait la plus grande part de marché dans le marché des systèmes de Dossier Maître d'Essai Électronique (eTMF) ?
L'Amérique du Nord avait la plus grande part du marché.
Veuillez remplir le formulaire ci-dessous pour recevoir un échantillon gratuit de ce rapport
Customer Stories

“This is really good guys. Excellent work on a tight deadline. I will continue to use you going forward and recommend you to others. Nice job”

“Thanks. It’s been a pleasure working with you, please use me as reference with any other Intel employees.”

“Thanks for sending the report it gives us a good global view of the Betaïne market.”

“Thank you, this will be very helpful for OQS.”

“We found the report very insightful! we found your research firm very helpful. I'm sending this email to secure our future business.”

“I am very pleased with how market segments have been defined in a relevant way for my purposes (such as "Portable Freezers & refrigerators" and "last-mile"). In general the report is well structured. Thanks very much for your efforts.”

“I have been reading the first document or the study, ,the Global HVAC and FP market report 2021 till 2026. Must say, good info! I have not gone in depth at all parts, but got a good indication of the data inside!”

“We got the report in time, we really thank you for your support in this process. I also thank to all of your team as they did a great job.”
