北美:监管领导与创新
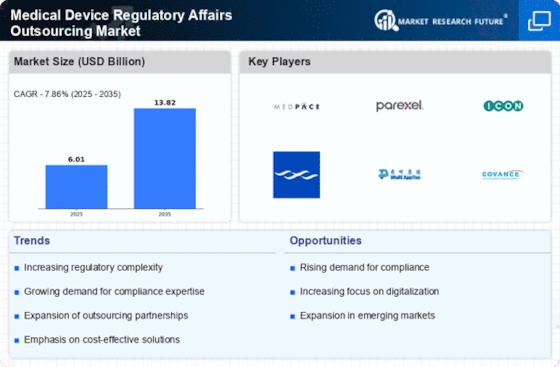
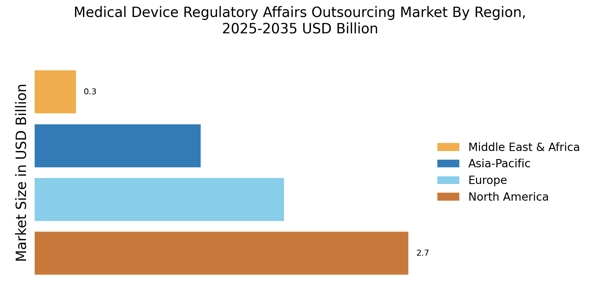
北美仍然是医疗器械监管事务外包的最大市场,约占全球市场份额的45%。该地区受益于强大的监管框架,由FDA的严格指南和对创新医疗技术的高需求推动。法规日益复杂以及合规需求的增加正在推动外包服务的增长。
美国是该领域的领先国家,主要企业如Medpace、PAREXEL和ICON plc均在此设有总部。加拿大也做出了重要贡献,专注于监管合规和市场准入策略。竞争格局由一系列成熟公司和新兴企业组成,所有公司都在争夺这一丰厚市场的份额。
欧洲:监管协调与增长
欧洲是医疗器械监管事务外包的第二大市场,约占全球市场的30%。该地区的增长受到医疗器械法规(MDR)和体外诊断法规(IVDR)实施的推动,这增加了对监管专业知识的需求。德国和法国等国处于前沿,推动医疗器械的合规与创新。
德国在市场中处于领先地位,得益于强大的制造基础和对研发的重视。法国和英国也发挥着重要作用,许多外包公司满足医疗器械公司的监管需求。竞争格局由本地和国际参与者共同构成,包括ICON plc和Charles River Laboratories,增强了该地区的能力。
亚太地区:快速增长与新兴市场
亚太地区正在迅速崛起,成为医疗器械监管事务外包市场的重要参与者,约占全球市场份额的20%。该地区的增长受到医疗支出增加、老龄化人口上升和医疗器械制造扩张的推动。中国和印度等国在这一增长中处于领先地位,得益于有利的政府政策和对医疗基础设施的投资。
中国是该地区最大的市场,越来越多的本地和国际公司寻求监管支持。印度紧随其后,医疗器械行业蓬勃发展,专注于合规和质量保证。竞争格局正在演变,关键参与者如WuXi AppTec和Covance正在建立强大的市场存在,满足该地区多样化的监管需求。
中东和非洲:新兴机会与挑战
中东和非洲(MEA)地区正在逐步发展其医疗器械监管事务外包市场,目前约占全球市场份额的5%。增长受到医疗投资增加和各国提升医疗系统所需的监管合规的推动。南非和阿联酋等国在此方面处于领先地位,专注于建立强大的监管框架以吸引外资。
南非是该地区最大的市场,越来越多的本地公司提供监管服务。阿联酋也正在成为医疗器械的中心,得益于政府旨在改善医疗标准的举措。竞争格局由本地和国际参与者共同构成,所有公司都在努力应对不断变化的监管环境。